Enlace químico

Generalidades sobre el enlace químico
Un enlace químico es el conjunto de fuerzas que mantienen unidos a los átomos, iones y moléculas cuando forman distintas agrupaciones estables.
- La energía de enlace es la cantidad de energía necesaria para romper el enlace entre dos átomos, separándolos a una distancia infinita.
- La regla del octeto permite explicar la formación de moléculas y compuestos químicos debido a la tendencia de los átomos a adquirir la configuración electrónica estable del gas noble más próximo a ellos (completar con ocho electrones su última capa).
El enlace iónico
Un ion es la partícula que se obtiene cuando un átomo o grupo de átomos capta o cede electrones con objeto de adquirir la configuración de gas noble, existen dos tipos de iones, el anión o ion cargado negativamente, o el catión o ion cargado negativamente. Se llama enlace iónico a la unión de iones con cargas diferentes mediante fuerzas de tipo electrostático.
| Na — 1e- → Na+ |
| Cl + 1e- → Cl— |
| Na+ + Cl— → NaCl |
Propiedades de los enlaces quimicos
- Son sólidos a temperatura ambiente.
- Conducen electricidad en medio acuoso.
- Poseen altos puntos de fusión.
- Son duros pero frágiles.
- Son resistentes a la dilatación.
- Son muy solubles en agua.
- Poseen diferentes electronegatividad.
El enlace covalente
Se forma cuando dos átomos comparten un par de electrones entre ellos, este es el tipo de enlaces predominantes en los compuestos orgánicos, los compuestos covalentes forman moléculas.
Representación de un enlace covalente
Cuando intentamos representar un enlace o construir fórmulas de compuestos es de mucha utilidad la notación propuesta por Lewis que consiste en una representación del átomo donde el símbolo representa al elemento y los puntos alrededor del símbolo a los electrones de valencia.
Estructura de Lewis de los compuestos
- Sume todos los electrones de valencia en todos los átomos del compuesto.
- Escriba el esqueleto estructural de los átomos y únalos con enlaces sencillos (dos electrones por enlace).
- Del total de electrones reste la cantidad utilizada en los enlaces.
- Distribuya los pares de electrones restantes alrededor de cada átomo en tal forma que cada átomo contenga una estructura de gas noble.
- Si no hay suficientes electrones convierta los enlaces sencillos en múltiples a fin de obtener la estructura de gas noble.
Ejemplo 1 - Estructura de Lewis del agua (H2O)
- H2 tiene 2e- y O tiene 6e- entonces 2e- +6e- = 8e-
- Escribo el esqueleto con enlaces sencillos H:O:H
- Resto la cantidad de electrones utilizados en el enlace 8e- — 4e- = 4e-
- Distribuir los pares restantes.
..
H:O:H
¨
Sólidos metálicos
Se mantienen unidos por una alta densidad de electrones deslocalizados, compartidos, lo que resulta en un "enlace metálico". Los ejemplos clásicos son los metales tales como el cobre y el aluminio, pero algunos materiales son metales en un sentido electrónico, pero tienen un enlace metálico despreciable en un sentido mecánico o termodinámico.
- Se deforman fácilmente sin perder su estructura cristalina.
- Son buenos conductores de electricidad.
- Tienen excelente conductividad térmica.
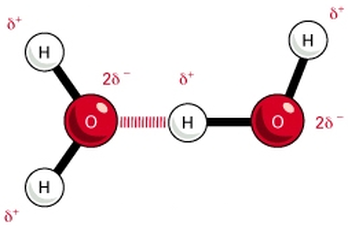
Fuerzas intermoleculares
Actúan sobre distintas moléculas o iones y que hacen que éstos se atraigan o se repelan. Estas fuerzas son las que determinan las propiedades físicas de las sustancias como, por ejemplo, el estado de agregación, el punto de fusión y de ebullición, la solubilidad, la tensión superficial, la densidad, entre otros.
- Interacción dipolo-dipolo: el polo positivo se dirige al polo negativo, fuerza de atracción débil.
- Puentes de hidrógeno: Enlace covalente a átomos electronegativos pequeños, fuerza de atracción muy fuerte.
.png)
- Fuerzas de London: Atracciones debilesen los gases, depende del numero de electrones, tamaño y forma moleculares.
- Ion-dipolo: Son las que se establece entre un ion y una molecula polar.
.png)
.png)
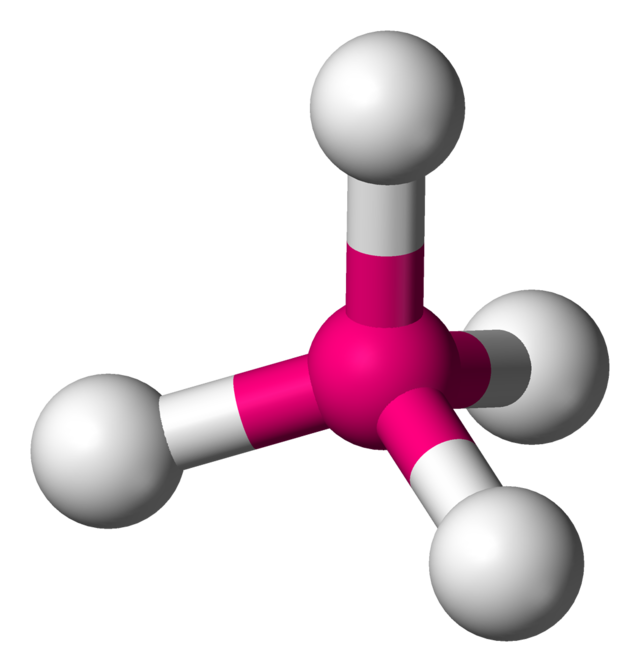
Arquitectura molecular: formas geométricas de las moléculas
Se entiende por arquitectura molecular la forma geométrica de la molécula
- La geometría molecular angular (también llamada en forma de V) describe la disposición de los electrones en el espacio en torno a aquellas moléculas de tipo AX2E1 o AX2E2, según la VSEPR, es decir, aquellas moléculas con dos pares de electrones enlazantes y uno o dos pares no enlazantes.
- La geometría molecular piramidal cuadrada describe la forma o geometría molecular de ciertos compuestos de fórmula química ML5, donde M es un átomo central y L es un ligando. Si los átomos del ligando estuviesen conectados, la forma resultante sería la de una pirámide de base cuadrada.
- La geometría molecular tetraédrica es un tipo de geometría molecular en la que un átomo central está en el centro enlazado químicamente con cuatro sustituyentes en las esquinas de un tetraedro.



Comentarios
Publicar un comentario