Compuestos oxigenados: Alcoholes, Fenoles y Éteres

Alcoholes
Son compuestos orgánicos cuyas moléculas tienen un grupo hidroxilo (OH-) unido de forma covalente a un átomo de carbono saturado.
Los alcoholes se clasifican en primarios, secundarios y terciarios, dependiendo si el átomo de carbono que posee el grupo hidroxilo esta enlazado a uno, dos o tres carbonos respectivamente.
| Tipo | Fórmula | Ejemplo |
|---|---|---|
| Primario |  |
 |
| Secundario | 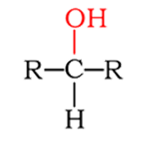 |
 |
| Terciario |  |
 |
Nomenclatura de los alcoholes
- Identifique la cadena de carbonos más larga que contenga el grupo hidroxilo.
- Numere la cadena comenzando por el extremo más cercano al grupo OH- para que tenga la numeración más baja.
- Forme el nombre del alcohol agregado el sufijo “ol” (diol si posee dos OH o triol respectivamente) al nombre de la cadena principal según su número de carbono.
- Los radicales se ordenan alfabéticamente antecediendo a la cadena principal.
Ejemplos
|
|
| 3-metilpentanol | 3-etil-6-metil-2,4,5-heptanotriol |
Propiedades de los alcoholes
- Los alcoholes son líquidos incoloros de baja masa molecular y de olor característico.
- Son solubles en el agua en proporción variable y menos densos que ella.
- Al aumentar la masa molecular, aumentan sus puntos de fusión y ebullición.
- Pueden ser sólidos a temperatura ambiente.
- Los alcoholes pueden ser ácidos o bases según el medio en el que se encuentre.
CH3-OH + HCl ↔ CH3-OH2 + Cl-
(base débil + acido fuerte ↔ ion oxonio + ion cloruro)
CH3-OH + H2O ↔ CH3-O- + H3O+
(ácido débil + agua ↔ ion alcóxido + ion hidronio)
Fenoles
Son compuestos que resultan de reemplazar un hidrógeno o más de su anillo aromático por uno o más OH. El miembro más simple e importante de esta familia es el hidroxibenceno o Fenol.
|
|
|
|
|
| Fenol | Catecol | Resorcinol | Ortocresol | Hidroquinona |
Nomenclatura de los fenoles
- Para nombrar los fenoles se utiliza el mismo procedimiento a los hidrocarburos aromáticos
- Si existen varios radicales -OH, se numeran los átomos de carbono del benceno de modo que los carbonos con grupos hidroxilo les corresponda la numeración más baja en conjunto, si hay varias posibilidades decidirá el orden de preferencia alfabético de los radicales.
- Al nombrar los polifenoles, deben escribirse los localizadores y los prefijos correspondientes: di, tri, etc. Cuando el grupo OH no es la función principal se utiliza el prefijo "hidroxi-" acompañado del nombre del hidrocarburo.
Ejemplos
|
|
| para-clorofenol | 4-ciclohexilcatecol |
|
|
| 3-bromo-2-nitrofenol | 1,3-diisopropilhidroquinona |
Propiedades de los fenoles
- Es un sólido que cristaliza como agujas incoloras de olor particular. Su temperatura de fusión es de 38°C y su punto de ebullición de 181°C. es higroscópico, es decir, absorbe mucha agua.
- Se puede oxidar ante la luz adquiriendo una coloración rosada. Es cáustico.
- Es poco soluble en agua. Muy soluble en éter y alcohol.
- Químicamente se comporta como ácido débil. Produce por lo tanto iones hidrógeno al disociarse.
Síntesis y reacciones de los fenoles
| Halogenación |
 |
| Sulfonación |
 |
| Nitración |
 |
Reconocimiento de los fenoles
Reacción con Cloruro férrico (FeCl3) En esta reacción el hierro (Fe) se une al grupo fenóxido. Los iones fenóxido son aún más reactivos que los fenoles hacia la sustitución aromática electrófila, ya que tienen una carga negativa reaccionan con electrófilos (en este caso Fe) para formar complejos.
Éteres
La fórmula general de los éteres es R-O-R´, los grupos R y R´ pueden ser derivados de los hidrocarburos saturados, insaturados o aromáticos y para un éter dado pueden ser iguales o diferentes.
Los alcoholes (R-OH) y los éteres (R-O-R) son isómeros funcionales, tienen la misma fórmula molecular pero diferente formula estructural.
Etanol … C2H6O… CH3-CH2-OH
Éter dimetílico… C2H6O… CH3-O-CH3
Propiedades
- Las propiedades químicas y físicas de estas dos moléculas (etanol y éter dimetílico) son muy diferentes, el etanol hierve a 78,3 °C y el éter dimetílico a -23,7 °C.
- El etanol forma enlaces de hidrógeno intermoleculares y es más soluble en agua.
Nomenclatura de los éteres
- Identifique la cadena de carbonos más larga que contenga el grupo alcoxi (-O-).
- Sustituir el sufijo “il” del radical (cadena de menor tamaño) por “oxi”.
- Escriba el nombre del radical seguida del nombre de la cadena principal como un alcano.
- También se nombran con la palabra éter indicando los grupos (en forma de radicales) que se encuentran unidos al oxígeno y el sufijo ílico en la cadena principal.
Ejemplos
|
|
| 2-etoxi butano | etoxi etano |
|
|
| 3-(2-metilproxi)hexano | isopropoxi benceno |
















Comentarios
Publicar un comentario